soal dari kelompok dan kelompok lain
Soal dari tugas kelompok ( chapter 8)
1. Golongan dan periode dari unsur P dalam sistem periodik unsur adalah
a golongan IA, periode 3
b. golongan IVA, periode 3
C. golongan VA, periode 3
d. golongan IVA, periode 4
e. golongan VA, periode 4
Pembahasaan:
Konfigurasi elektron P: 2, 8, 5
Unsur P memiliki elektron valensi = 5,
maka terletak pada golongan VA Jumlah kulit = 3 maka terletak pada periode 3
Jadi, unsur 15P dalam sistem periodik unsur terletak pada golongan VA, periode 3.
Jawaban : C
2. Unsur yang didalam sistem periodik terletak pada golongan IIIA periode 3 dan jumlah neutronnya 14, mempunyai nomor massa …
a 27
b. 28
C. 29
d. 30
e. 31
Pembahasan:
Golongan IIA periode 3 menghasilkan konfigurasi: 2, 8, 3.
Berdasarkan konfigurasi maka jumlah elektron dan jumlah protonnya adalah 13.
Nomor massa = jumlah proton + neutron = 13 + 14 = 27
Jawaban: A
3. Unsur yang bernomor atom 12 akan mempunyai sifat yang mirip dengan unsur
yang bernomor atom ...
a.10
b.17
C.19
d.20
e.24
Pembahasan:
Unsur dengan nomor atom 12 memiliki konfigurasi: 2, 8, 2. Unsur dengan nomor atom 20 memiliki
konfigurasi: 2, 8, 8, 2. Kedua unsur mempunyai elektron valensi sama maka keduanya juga mempunyai sifat yang mirip.
Jawaban: D
4. Dalam periode yang sama bila dibandingkan dengan unsur golongan alkali tanah, maka unsur golongan alkali mempunyai sifat-sifat
a kurang reaktif
b. energi ionisasinya lebih besar
C afinitas elektronnya lebih besar
d. keelektronegatifannya lebih besar
e. jari-jari atomnya lebih panjang
Pembahasan:
Dalam periode yang sama unsur golongan alkali (IA) mempunyai jari-jari atom lebih panjang dibanding golongan alkali tanah (ITA) karena muatan inti dan jumlah elektronnya makin berkurang sehingga makin lemah gaya tarik inti terhadap elektron terluar.
Jawaban: E
Dari tugas kelompok orang
chapter 1
1. Elektron valensi dari dari 20Ca adalah..
a. 6
b. 5
C. 4
d. 3
e 2
Pembahasan:
20Ca nomor atom 20, maka jumlah elektronnya juga 20
Konfigurasi elektron 20Ca = 2, 8, 8, 2
Elektron valensi 20Ca = 2
Jawaban: E
2. lon 20 Ca mempunyai proton, neutron dan elektron berturut-turut ...
A. 20, 20, 18
b. 20, 20, 20
c. 18, 20, 20
d. 20, 18, 20
e. 18, 18, 20
Pembahasan:
Pada ion positif terjadi pelepasan elektron.
Pada ion Ca 2 Terjadi pelepasan 2 elektron. Maka jumlah elektronnya = 20 - 2 = 18.
Untuk penentuan proton dan neutron sama dengan atom netral,
sehingga:
Jumlah proton = nomor atom = 20
Jumlah neutron = nomor massa - jumlah proton = 40 - 20 = 20
Jadi, jumlah proton, neutron, dan elektron berturut-turut adalah 20, 20, dan 18.
Jawaban: A
chapter 2
1. Perhatikan pernyataan dibawah ini.
- Menggambarkan susunan atom-atom dalam suatu molekul
- Menggambarkan distribusi atau sebaran elektron valensi disekitar atom-atom dalam suatu molekul.
- Menggambarkan jenis ikatan yang terjadi antara atom-atom dalam suatu molekul
- Menunjukkan panjang ikatan yang terdapat dalam suatu molekul
- Menggambarkan bentuk molekul dalam ruang tiga dimensi
1, 2, 3
1, 3, 4
2, 3, 4
2, 3 5
3, 4, 5
Pembahasan:
Struktur Lewis dapat menggambarkan
- Susunan atom-atom dalam molekul.
- Distribusi elektron disekitar atom atom suatu molekul.
- Jenis ikatan yang terdapat di dalam molekul
Struktur Lewis tidak dapat menunjukkan panjang ikatan yang terdapat dalam suatu molekul. Penentuan panjang ikatan harus melalui eksperimen.
Struktur Lewis juga tidak dapat menggambarkan bentuk molekul senyawa dalam ruang tiga dimensi karena struktur Lewis digambarkan dalam bidang datar.
Jawaban: A
2. Struktur Lewis yang tepat untuk atom bebas X dengan nomor atom 35 adalah………
Pembahasan:
Untuk membuat struktur Lewis suatu unsur, yang perlu kita tuliskan sebagai titik-titik (dot) disekitar atom adalah elektron valensinya, bukan seluruh elektron yang dimiliki oleh unsur tersebut.
Oleh karena itu, buat dahulu konfigurasi elektron dari unsur yang ingin digambarkan struktur lewisnya.
Konfigurasi elektron X (35) = 2 8 18 7
Elektron valensi adalah elektron pada kulit terakhir. Dari konfigurasi elektron diatas dapat kita ketahui bahwa elektron valensi unsur X adalah 7.
Jawaban: C
chapter 3
1. Huruf “l” pada persamaan reaksi kimia berarti ….
A. padat
B. cair
C. gas
D. larutan
E. lelehan
Jawaban: B. cair
Soal No. 4
2. Perhatikan persamaan reaksi kimia berikut.
Na2S2O3(aq) + I2(aq) → Na2S4O6(aq) + NaI(aq)
Agar persamaan reaksi kimia di atas setara, maka koefisien untuk Na2S2O3 dan NaI adalah ….
A. 1 dan 2
B. 1 dan 1
C. 2 dan 1
D. 2 dan 2
E. 2 dan 3
Jawaban: D. 2 dan 2
chapter 4
1. Sebanyak 5 gram CaCO3 direaksikan dengan 100 mL HCl 0,5 M menurut reaksi berikut:
CaCO3 (s) + HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g) (reaksi belum setara)
Volume CO2 yang terbentuk jika diukur pada suhu kamar sebanyak ….
- 0,2 L
- 0,4 L
- 0,6 L
- 0,8 L
- 1,0 L
Jawaban: C
Pembahasan:
Setarakan reaksi terlebih dahulu:
CaCO3 (s) + 2HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g)
Tentukan pereaksi pembatas.
Mol CaCO3 = 
Mol HCl = M x V = 0,5 M x 100 mL = 50 mmol = 0,05 mol
Sehingga, yang menjadi pereaksi pembatas adalah HCl. Pereaksi pembatas adalah zat yang memiliki  paling kecil.
paling kecil.
Persamaan reaksi:
CaCO3 (s) + 2HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g)
Mula – mula 0,05 0,05 - -
Reaksi 0,025 0,05 0,025 0,025 0,025
Sisa 0,025 - 0,025 0,025 0,025
Ingat! Perbandingan mol = perbandingan koefisien.
Mol CO2 = 0,025 mol.
Pada keadaan suhu kamar atau RTP (Room temperature Preasure) berlaku:

2. Perhatikan reaksi berikut ini!
- HF + H2O -> F- + H3O+
- NH3+ H2O -> NH4+ + OH-
- C6H5COOH + H2O -> C6H5COO- + H3O+
- RNH2+ H2O -> RNH3 + OH-
Air merupakan salah satu zat yang bersifat amfoter, artinya dapat bertindak sebagai asam maupun basa. Reaksi yang menunjukkan air bertindak sebagai basa adalah ….
- 1, 2, dan 3
- 1 dan 3
- 2 dan 4
- 4 saja
- 1, 2, 3, 4
Jawaban: B
Pembahasan:
Asam Basa Bronsetd-Lowry adalah pasangan asam basa yang hanya berbeda pada satu atom H saja. Asam memiliki atom H lebih banyak dibandingkan basa.
Pada reaksi (1) HF + H2O -> F- + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
Pada reaksi (3) C6H5COOH + H2O -> C6H5COO- + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
chapter 5
1. Gas ideal berada dalam ruang tertutup dengan volume V, tekanan P dan suhu T. Apabila volumenya mengalami perubahan menjadi 1/2 kali semula dan suhunya dinaikkan menjadi 4 kali semula, maka tekanan gas yang berada dalam sistem tersebut menjadi….
A. 8 P1
B. 2 P1
C. 1/2 P1
D. 1/4 P1
E. 1/8 P1
Pembahasan:
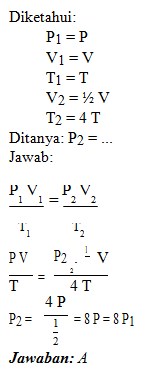
Jawaban : A
2. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika suhu gas menjadi 3/2 T dan tekanannya menjadi 2 P, maka volume gas menjadi ….
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 3 V
E. 4 V
Pembahasan:

Jawaban : A
chapter 6
1. Jika diketahui:
![]()
Perubahan entalpi pada penguraian 1 mol gas NH3 menjadi unsur-unsurnya adalah….
a. -92 kJ
b. -46 kJ
c. +46 kJ
d. + 184 kJ
e. + 92 kJ
Pembahasan:
Dalam soal di atas dapat dilihat merupakan pembentukan reaksi. Pada dasarnya, perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tandanya.
Tapi pada reaksinya NH3 memiliki 2 mol sehingga jika diminta 1 mol nya, 92 sehingga pada 1 mol NH3 menjadi +46
Jawaban : C
2. Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
a. 740 kJ
b. 470 kJ
c. 740 kJ
d. 470 kJ
e. 740 kJ
(Kimia untuk SMA/MA Kelas XI, Unggul Sudarmo, Erlangga, 2013, hal.66)
Pembahasan:
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran 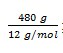 karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
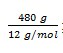 x 393,5 kJ/mol
x 393,5 kJ/mol
= 15.740 kJ
Jawaban : A
chapter 7
A. Atom terdiri dari elektron - elektron
B. Elektron sebagai penyusun utama atom
C. Atom sebagai bola masif yang hanya berisi elektron
D. Atom sebagai bola masif bermuatan positif yang di dalamnya tersebar elektron sehingga keseluruhannya bersifat netral
E. proton dan elektron adalah bagian penyusun atom yang keduanya saling meniadakan.
Pembahasan :
Teori atom Thomson
Atom terdiri dar inti bermuatan positif dan elektron yang menyebar rata di permuakaan atom. Model atom thomson dikenal juga dengan model atom roti kismis.
Jawaban : D
2. Teori yang menjadi dasar munculnya teori atom modern adalah . . . .
A. spektrum atom hidrogen
B. tabung sinar katode
C. penghamburan sinar alfa
D. adanya sinar saluran
E. mekanika gelombang
Pembahasan :
Dasar munculnya teori atom modern adalah adanya teori mekanika gelombang yang dikemukakan oleh Heisenberg, Shcrodinger dan de Broglie.
Jawaban : E
chapter 9
chapter 10
1. Jika nomor atom B = 5 dan nomor atom Cl = 17. Orbital hibrida yang terjadi pada molekul BCl3 adalah ….
A. sp
B. sp2
C. sp3
D. sp3d
E. sp3d2
Jawaban: B
2. Bentuk molekul bipiramida trigonal memiliki orbital hibrida ….
A. sp
B. sp2
C. sp3
D. sp3d
E. sp3d2
Jawaban: D
Penyelesaiannya:
Bentuk molekul berdasarkan teori hibridisasi dapat kita lihat
dalam tabel bentuk molekul berikut.
|
Jenis Orbital |
Orbital Hibrida |
Bentuk Molekul |
Contoh |
|
s dan p |
sp |
Linear |
BeCl2 |
|
s dan p |
sp2 |
Segitiga planar |
BF3 |
|
s dan p |
sp3 |
Tetrahedral |
CH4 |
|
s, p, dan d |
sp3d |
Bipiramida trigonal |
PCl5 |
|
s, p, dan d |
sp3d2 |
Oktahedral |
SF6 |
chapter 11
- CH4
- HCl
- NH3
- C6H13NH2
- NaCl
- CH3Cl
- H2S
- Kr
Gaya dispersi hanya dimiliki oleh molekul-molekul nonpolar dan atom golongan gas mulia.
Bila sudah terbiasa maka dengan cepat dapat ditentukan.
CH4
C atom pusat (jumlahnya hanya 1 atom).
C mempunyai e-valensi 4
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 4 atom → X4
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 4 – (4 × 1) = 4 – 4 = 0
PEB = 0 → E0
CH4 → sistem AX4E0→ AX4E0 → bentuk molekul tetrahedral → nonpolar
HCl → molekul polar, molekul diatomik tetapi beda nilai keelektronegatifannya sehingga akan terjadi pengkutuban atau dipol, elektron tertarik ke atom yang memiliki keelektronegatifan lebih besar. Cl lebih elektronegatif dibanding H.
NH3→ Sama dengan AsH3 bahasan soal nomor 1, sebab N segolongan dengan As. NH3 bersifat polar.
C6H13NH2→ molekul polar, seperti pada NH3 memiliki 1 PEB pada N, berbentuk piramida segitiga, bentuk tidak simetri, C6H13 ini adalah pengganti 1 atom H pada NH3 .
NaCl → senyawa ionik, jelas tidak bersifat nonpolar.
CH3Cl → bentuk molekulnya seperti CH4, 1 atom H diganti atom Cl. Karena Cl memiliki keelektronegatifan berbeda dengan H maka sifat molekulnya polar.
H2S →
S atom pusat (jumlahnya hanya 1 atom).
S mempunyai e-valensi 6
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 2 atom → X2
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 6 – (2 × 1) = 6 – 2 = 4
PEB = jumlah EB/2 = 4/2 = 2 → E2
H2S → sistem AX2E2→ bentuk molekul bengkok → polar
Kr → atom golongan gas mulia → nonpolar.
Kesimpulan, dari pilihan molekul yang tersedia yang bersifat nonpolar adalah CH4 dan Kr. Jadi yang memiliki gaya dispersi adalah CH4 dan Kr.
2. Ketika NaCl larut dalam air, menghasilkan Na+ dan Cl– sebagai larutan. Gaya tarik menarik yang terjadi antara Na+ dan air disebut interaksi.....
- dipol-dipol
- ion-ion
- ikatan hidrogen
- ion-dipol
- gaya dispersi.
Dengan menyimak tabel berikut maka dengan jelas dapat ditentukan. Jawaban yang tepat D. Ion-dipol.
chapter 12
1. Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,2 g/ml. Berapa kemolala larutan adalah …. (Mr fruktosa = 180)
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Jawaban : C
Pembahasan
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
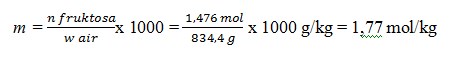
2. Fraksi mol larutan methanol CH3OH dalam air adalah 0,50. Kosentrasi methanol dalam arutanini dinyataan dalam persen berat methanol adalah …. Ar C = 12, O = 16, H =1
a. 64 %
b. 54%
c. 63%
d. 62%
e. 60%
Jawaban : A
Pembahasan :
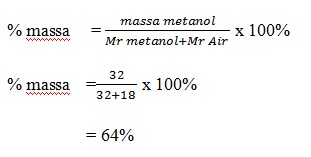




Tidak ada komentar:
Posting Komentar